阅读:0
听报道
大脑皮层中大部分锥体神经元(兴奋性)排列的中规中矩,是各类信息存储、更新与计算、生成的细胞基础。而穿插其中的抑制性的中间神经元名目繁多,从形态到基因表达都可以分为多个类群。它们都释放抑制性的神经递质gamma-氨基丁酸(GABA)。神经递质与神经元是多对多的关系,兴奋性与抑制性神经元都可能有多种兴奋性或抑制性的神经递质,多了一些可调节的参数。例如抑制性神经元的可以同时含有释放兴奋性的谷氨酸和释放抑制性的 GABA突触前囊泡 。这些抑制性神经元对其下游的锥体神经元或中间神经元的输出信号的强度和节奏起到调制作用。抑制性的中间神经元是大脑中不可或缺的部分,对于维持感知速度、记忆、联想学习和睡眠都是必不可少的。成熟的大脑没有那么多的神经布线(wiring)工作,尤其在清醒状态下,大脑更多是进行局部的优化。
对小鼠躯体感觉皮层第4层的三维图像分析表明,轴突周围裸露出的神经元膜的表面积越多,越有可能存在突触连接[1]。在拥挤的大脑皮层中(如上一节的图),笔者猜想,每个锥体神经元的表面需要先由中间神经元,或者其他辅助细胞(如胶质细胞)将其保护起来(无法被其他锥体神经元建立连接),等在合适的刺激下,中间神经元会释放一些锥体神经元表面供突触连接产生。我们在本书后部从关联到因果关系的阐述中也会涉及这方面的猜想。
这样被保护的初始设置,加上很多中间神经元之间有比化学突触速度更快的电突触连接,意味着在幼年期锥体神经元倾向于一大群一起激活,随着经历的增长才逐渐切分出更多小模块。而上述过程意味着中间神经元的作用,可能是避免建立错误或过于细节的连接。这样的机制,或可应用于神经网络的训练。
一项针对初级视觉皮层的研究发现,同层的抑制性神经元间以及同层的兴奋性神经元间的连接,相比同层中的兴奋神经元与抑制神经元间的连接(无论那个连接方向),同类神经元间连接的空间距离的更大(更多长程连接)[2]。同类神经元间的连接,可看作是位于更大尺度上的网格,能够处理更全局的信息与关联。而抑制性神经元对兴奋性神经元的调控则发生在局部。
一项基于循环神经网络的神经系统模拟研究发现,抑制性中间神经元可能对学习一般性特征更重要,而兴奋性锥体神经元编码具体对象[3]。通过加入抑制性神经元,能够抽取多个对象中具有一般性特征,可以类比CNN中的最大池化层(图1),用以提升检测信号的尺度/旋转不变性。综合上述研究,抑制性中间神经元不只是传统理解的刹车片、灭火器,而是能够在较大的空间尺度上协调多个兴奋性的锥体神经元的活动,是自带参数的神经网络基础设施的一部分。我们后文还会讲到星形胶质细胞(astrocytes)等非神经元类细胞,也属于参与神经活动的基础设施。
图5.1:最大池化操作示意图。
早年根据中间神经元的形态,如今根据其表达的蛋白质,对中间神经元进行分类,这两种不同技术得出的分类存在对应关系(图5.2),但是这增加了文献阅读时的隔阂。例如形态鉴定得到的Martinotti 细胞,在单细胞转录组等研究报道中表达生长抑素(somatostatin,缩写为SST或SOM) ,后者今年来更常出现,而没有采用传统染色技术进行形态学鉴定。
经典形态分类的大的篮状细胞(large basket cells,大的更多,后文篮状细胞默认属于此类)和枝形细胞(chandelier cells)都表达小清蛋白(parvalbumin,PV),小的篮状细胞和其他细胞表达血管活性肠肽(vasoactive intestinal peptide,VIP)。大脑皮层第1层的抑制性突触更多,除了Martinotti 细胞(树突在第1层,细胞体可以在更深处,图5.2B),也属于中间神经元的Neurogliaform细胞(神经胶质样细胞)在大脑皮层第1层较多,后文也会讲到它的重要功能。

图5.2 抑制性中间神经元的经典形态学分类与基因表达分类的对应关系。(A)按PV、SST、Htr3a基因表达分三大类后安形态及基因表达细分。(B)所示小鼠大脑皮层区域抑制性中间神经元在各层的分布。(C)各类抑制性中间神经元的相对数目。可以看到表达PV的大篮状细胞是最多的。来自[3]。
不同的中间神经元有着不同的功能。表达小清蛋白的大篮状细胞的数目最多,我们在睡眠、速度感知等章节都会看到它们。小清蛋白(parvalbumin,PV)是快进快出的一类结合钙离子的蛋白,使得大篮状细胞有更快的响应速度,还可以反向传播(back-propagation)。表达血管活性肠肽(VIP)的中间神经元抑制其他中间神经元,是一种否定之否定的调控机制。例如当V1视觉皮层预测有误时,丘脑的VIP中间神经元对V1中一些表达生长抑素(SST)的中间神经元的抑制解除,实现局部的参数调整[4]。
经由表达小清蛋白的中间神经元,第2层的一个锥体神经元活动可以直接抑制同一层或下一层的另一个锥体神经元。我们在这个互斥性的协作单元中已经看到了因果图的影子。
中间神经元还参与其他一些有重要意义的功能,例如对弱信号的放大、对不一致信息的决策。大脑前额叶皮层中表达小清蛋白的中间神经元接受来自丘脑的表达多巴胺受体的神经元输入,在输入的提示信号稀疏时,仍可以基于微弱证据作出决策。大脑前额叶皮层中表达小清蛋白的中间神经元还接受来自丘脑的表达谷氨酸卡因受体(GRIK4)的神经元,在提示信号嘈杂或互相冲突时,仍能作出决策[5]。
压力引起的恐惧记忆扩大化,也涉及表达小清蛋白的中间神经元没有充分参与[6]。
一项对已去世阿尔茨海默症患者大脑的单细胞研究报道,患者在多种抑制性神经元以及免疫、辅助细胞出现了异常——阿尔茨海默症早期患者病理进展较慢,这些早期患者表达生长抑素的抑制性神经元减少,有促炎的小胶质细胞、反应性星形胶质细胞,还有少突胶质前体细胞修复髓鞘损伤;在病理损伤加速进展的后期,表达小清蛋白的抑制性神经元、表达血管活性肠肽的中间神经元和兴奋性神经元也减少了[7]。
虽然诸如重新连接(rewiring)和回路(circuit)这样的术语在文献中已经很流行,但成年人大脑皮层的大部分是由兴奋性的锥体神经元紧密排列而成的既定框架,抑制性神经元和兴奋性神经元的数目(图2,灰质体积)和相邻关系大部分也已经在发育过程中形成。我们过两节会进一步介绍神经细胞的网络连接。
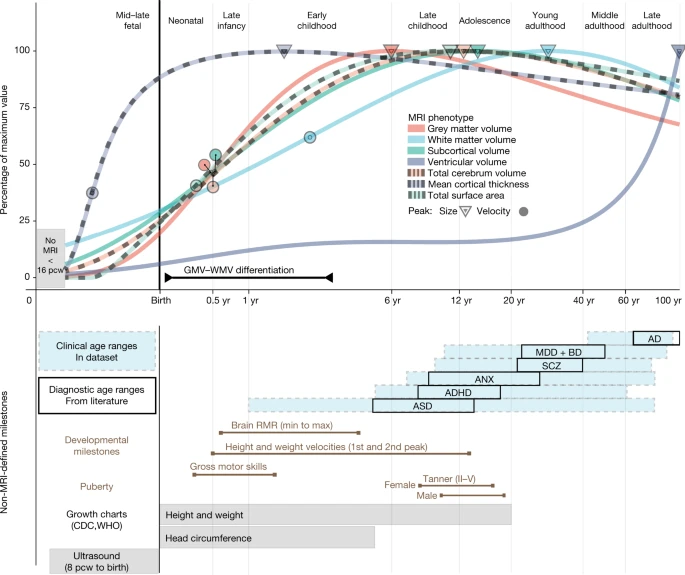
图2 神经发育的里程碑。RMR,resting metabolic rate,静息代谢率。疾病缩写均为主流:ASD,自闭症,ADHD,多动症,ANX,焦虑症,SCZ,精神分裂症,MDD,重度抑郁,BD,双相情感障碍,AD,阿尔茨海默症。来自[8]。
参考文献:
[1] Motta, A. et al. Dense connectomic reconstruction in layer 4 of the somatosensory cortex. Science (80-). 366: eaay3134. doi: 10.1126/science.aay3134. (2019).
[2] Campagnola, Luke, Stephanie C. Seeman, Thomas Chartrand, Lisa Kim, Alex Hoggarth, Clare Gamlin, Shinya Ito, et al. 2022. “Local Connectivity and Synaptic Dynamics in Mouse and Human Neocortex.” Science 375 (6585). https://doi.org/10.1126/science.abj5861.
[3] Lim L, Mi D, Llorca A, Marín O. Development and Functional Diversification of Cortical Interneurons. Neuron. 2018 Oct 24;100(2):294-313.
[4] Furutachi, S., Franklin, A. D., Aldea, A. M., Mrsic-Flogel, T. D., & Hofer, S. B. (2024). Cooperative thalamocortical circuit mechanism for sensory prediction errors. Nature, 1–9. https://doi.org/10.1038/s41586-024-07851-w.
[5] Mukherjee, Arghya, Norman H. Lam, Ralf D. Wimmer, and Michael M. Halassa. 2021. “Thalamic Circuits for Independent Control of Prefrontal Signal and Noise.” Nature 600 (7887): 100–104. https://doi.org/10.1038/S41586-021-04056-3.
[6] Lesuis, S. L., Park, S., Hoorn, A., Rashid, A. J., Mocle, A. J., Salter, E. W., Vislavski, S., Gray, M. T., Torelli, A. M., DeCristofaro, A., Driever, W. P. F., Mario, Zweifel, L. S., Collingridge, G. L., Lefebvre, J. L., Walters, B. J., Frankland, P. W., Hill, M. N., & Josselyn, S. A. (2024). Stress disrupts engram ensembles in lateral amygdala to generalize threat memory in mice. Cell. https://doi.org/10.1016/j.cell.2024.10.034
[7] Gabitto, M. I., Travaglini, K. J., Rachleff, V. M., Kaplan, E. S., Long, B., Ariza, J., Ding, Y., Mahoney, J. T., Dee, N., Goldy, J., Melief, E. J., Agrawal, A., Kana, O., Zhen, X., Barlow, S. T., Brouner, K., Campos, J., Campos, J., Carr, A. J., & Casper, T. (2024). Integrated multimodal cell atlas of Alzheimer’s disease. Nature Neuroscience. https://doi.org/10.1038/s41593-024-01774-5
[8] Bethlehem, R. A. I. et al. Brain charts for the human lifespan. Nature. 604, 525–533 (2022).
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 